| 제목 | 장쇄지방산 1: 장쇄지방산(LCFA)의 항균, 항염, 잇몸누수, 장누수 방어효과 | ||||
|---|---|---|---|---|---|
| 작성자 | 닥스메디 | 등록일 | 2022.5.19 | 조회수 | 136290 |
|
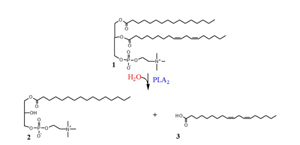
** 장내세균 중 프로바이오틱스 미생물이 만드는 단쇄지방산(SCFA, Short Chain Fatty Acid) 의 항균 항염효과는 잘 알려져 있다. 같은 지방산(Fatty acid) 이더라도 단쇄(짧은 사슬, short) 지방산 보다, 긴(long) 탄소고리 사슬을 가진 장쇄지방산(LCFA, Long Chain Fatty Acid) 의 항균 항염 효과도 기대해 볼만하다. 실제 내가 참여하고 있는 회사, 닥스메디는 이에 대한 장쇄지방산의 구강유해균 억제에 대한 특허를 가지고 있기도 하다. 복잡해 보이는 화학구조식이 나도 익숙치 않아, 공부삼아 정리해 보려 한다. 요약은 위 다이아그램 1. 레시틴은, 흔한 지방산(fatty acid)이다. 생체막을 구성하는 주요 성분으로 계란노른자, 콩기름, 간, 뇌 등에 많다 한다. 이 레시틴에 가수분해효소( phospholipase A2) 를 섞으면, 레시틴이 가수분해되어, 라이소레시틴(lysolecithin, 레시틴이 분해되었다는 뜻) 과 리놀레산(linoleic acid) 가 만들어 진다. 2. 리놀레산 역시 많이 알려진 장쇄지방산으로, 화장품등에 사용되어 피부를 보호한다. 동시에 항균효과가 기대된다. 3. 우리가 가지고 있는 특허 내용은 다음과 같다.
A. 레시틴 가수분해물의 주성분인 리놀레산은 S. mutans, P. gingivalis, A. actinomycetemcomitans 등의 구강유해균 증식을 억제한다. 하지만 구강환경인 수용액에서 용해도가 낮고 리포좀/마이셀 형성이 어려워 분산 및 이동이 어려움. B. 리놀레산을 단독으로 처리했을 때 보다 리놀레산과 라이소레시틴을 함께 처리하였을 때, 즉 레시틴 가수분해물로 처리하였을 때 구강유해균 진지발리스(P. gingivalis) 의 억제효과가 높아진다. (최소저해농도가 현저히 낮아진다). 이유는 라이소레시틴이 리놀레산의 분산을 도와서 P. gingivalis로의 이동을 보다 빠르게 하였기 때문인 것으로 사료된다. 라이소레시틴이 일종의 계면활성제 역할을 하여, 지용성인 리놀레산의 delivery system으로 작용한다는 것. C. 다시말하면, 레시틴 가수분해물의 주성분인 라이소레시틴은 레시틴에 비해 친수성이 높아 수용액에서 구조적으로 안정한 liposome (리포좀) 또는 micelle (마이셀)을 형성하여 소수성인 리놀레산의 분산 및 delivery (이동)를 돕는다는 것. D. 해서, 리놀레산을 단독으로 처리했을 때 보다 리놀레산과 라이소레시틴을 함께 처리하였을 때 레시틴이 구강유해균 진지발리스 안으로 더 배달되어 항균력을 더 높일 수 있다는 것. 다시.. 결과적으로 라이소레시틴과 리놀레산의 공동작용으로 P. gingivalis 에 대해 높은 항균활성을 보임 4. 동시에 리놀레산은, 프로바이오틱스 미생물에 의해, 올레산(oleic acid) 을 만드는 중간과정으로 HYA(10-hydroxy-cis-12-octadecenoic acid), Keto C (0-oxo-trans-11-octadecenoic acids) 같은 물질을 만드는데, HYA 와 Keto C 역시 구강유해균에 대한 항균효과와 인체상피세포의 GPR 40, GPR 120 을 활성화 시켜, 항염효과도 갖는다. 또한 HYA 와 Keto C 는 GPR 40 의 활성화를 통해 구강과 장 상피세포간 결합단백질을 보호하여, 상피간 결합력을 높혀 잇몸누수, 장누수를 방지하는 효과를 기대할 수 있다는 것이다.
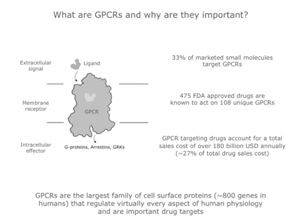
5. GPR( G protein-coupled receptor) 은 인간이나 동물같은 진핵세포에서만 존재하는 세포막의 수용체(receptor)로서, 긴 진화과정과 연관되어 있다는 단백질(evolutionarily related protein) 이다. GPR 수용체는 수백개에 달하는 family 라서 번호를 붙혀 구분한다. GPR 은 약물의 중요한 타켓으로 작용에 많이 관여하여,미국 FDA 허가약물의 약 38% 가 이 수용체들을을 타겟한다 6. 이중에서 GPR 40은 지방산 수용체로도 불리는 것으로, 주로 인슐린을 분비하는 췌장 베타세포에서 많이 존재한다. 췌장 베타세포 세포막의 gpr 40 이 장쇄지방산에 의해 활성화되면, 세포질내의 이러저런 과정(PATHWAY)을 거쳐, 인슐린이 분비되게 된다. 당연히 당뇨개선을 타겟으로 하여 많은 연구가 되었다. 동시에 GPR40 은 최근 상피세포간 결합력(tight juction) 을 개선하고 상피세포의 항염반응을 낮추는 것으로 알려지며, 잇몸누수, 장누수를 방어할 제재로 연구중이다. (Moonwiriyakit, Wattanaphichet et al. 2018) 7. 그 과정을 좀 더 구체적으로 보면,
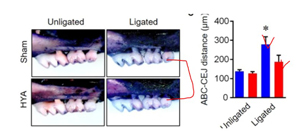
A. HYA 의 잇몸누수방지, in vitro & 동물실험(Yamada, Takahashi et al. 2018) In vitro HYA(10-Hydroxy-cis-12-octadecenoic acid) 가 P. gingivalis 가 일으킨 결합상피간 결합훼손 (잇몸누수) 을 회복하게 함. GPR 40 ( free fatty acid receptor 1 (FFAR1)) 가 활성화됨. 동물실험에서, HYA 가 치은조직의 염증성사이토카인(IL-1β, TNF-α and IL-6)을 감소시킴
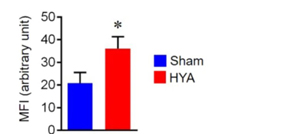
동물실험에서, HYA 가 구강상피세포 결합단백질인 E-cadherin 의 분해를 억제..농도 높아짐. 결합력이 더 높아지고, 잇몸누수를 방어할 수 있다는 의미
B. HYA 의 장누수방지, in vitro & 동물실험 (Miyamoto, Mizukure et al. 2015) 리놀레산을 장내세균(Lactobacillus plantarum)이 대사한 결과물 HYA(10-Hydroxy-cis-12-octadecenoic acid) 가 장상피세포인 Caco-2 cell 의 GPR 40 ( free fatty acid receptor 1 (FFAR1)라고도 불림) 을 활성화 시킴 쥐 장세포의 염증성사이토카인 TNF-α 를 억제함 장상피조직의 결합력을 높혀 장누수방어력을 높힘
C. Keto C 의 항염효과, in vitro(Sulijaya, Takahashi et al. 2018) Keto C 가 대식세포인 RAW 264.7 cell 에서 염증성사이토카인(TNFα, IL-6, IL-1β) 의 분비를 억제함
Miyamoto, J., T. Mizukure, S.-B. Park, S. Kishino, I. Kimura, K. Hirano, P. Bergamo, M. Rossi, T. Suzuki, M. Arita, J. Ogawa and S. Tanabe (2015). "A gut microbial metabolite of linoleic acid, 10-hydroxy-cis-12-octadecenoic acid, ameliorates intestinal epithelial barrier impairment partially via GPR40-MEK-ERK pathway." The Journal of biological chemistry 290(5): 2902-2918. Moonwiriyakit, A., P. Wattanaphichet, V. Chatsudthipong and C. Muanprasat (2018). "GPR40 receptor activation promotes tight junction assembly in airway epithelial cells via AMPK-dependent mechanisms." Tissue Barriers 6(2): 1-12. Sulijaya, B., N. Takahashi, M. Yamada, M. Yokoji, K. Sato, Y. Aoki-Nonaka, T. Nakajima, S. Kishino, J. Ogawa and K. Yamazaki (2018). "The anti-inflammatory effect of 10-oxo-trans-11-octadecenoic acid (KetoC) on RAW 264.7 cells stimulated with Porphyromonas gingivalis lipopolysaccharide." 53(5): 777-784. Yamada, M., N. Takahashi, Y. Matsuda, K. Sato, M. Yokoji, B. Sulijaya, T. Maekawa, T. Ushiki, Y. Mikami, M. Hayatsu, Y. Mizutani, S. Kishino, J. Ogawa, M. Arita, K. Tabeta, T. Maeda and K. Yamazaki (2018). "A bacterial metabolite ameliorates periodontal pathogen-induced gingival epithelial barrier disruption via GPR40 signaling." Scientific Reports 8(1): 9008.
|
|||||